Введение
В настоящей главе рассматриваются требования к качеству моноклональных антител.
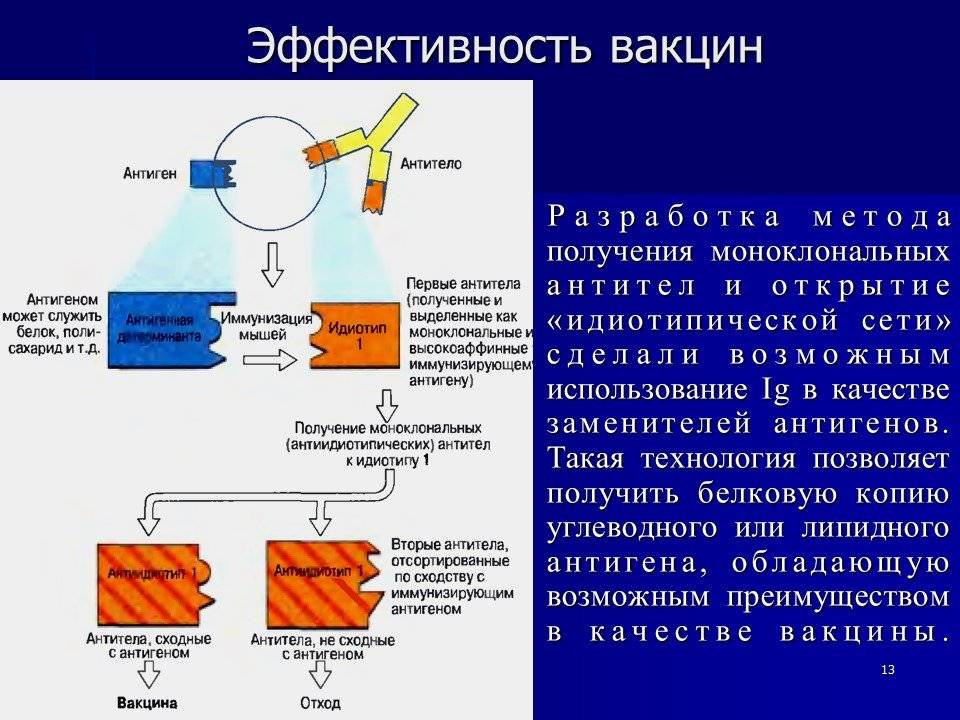
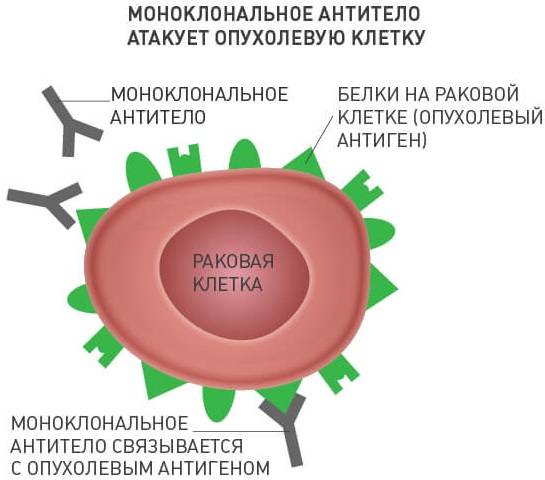
Моноклональные антитела — это Ig, характеризующиеся определенной специфичностью, источником получения которых являются линии клеток одного клона. Их биологическая активность проявляется за счет специфичного связывания с соответствующим лигандом (обычно определяемым как антиген) и обусловливает такие эффекторные функции иммунной системы, как антителозависимая клеточная цитотоксичность (ADCC) и комплементзависимая цитотоксичность (CDC).
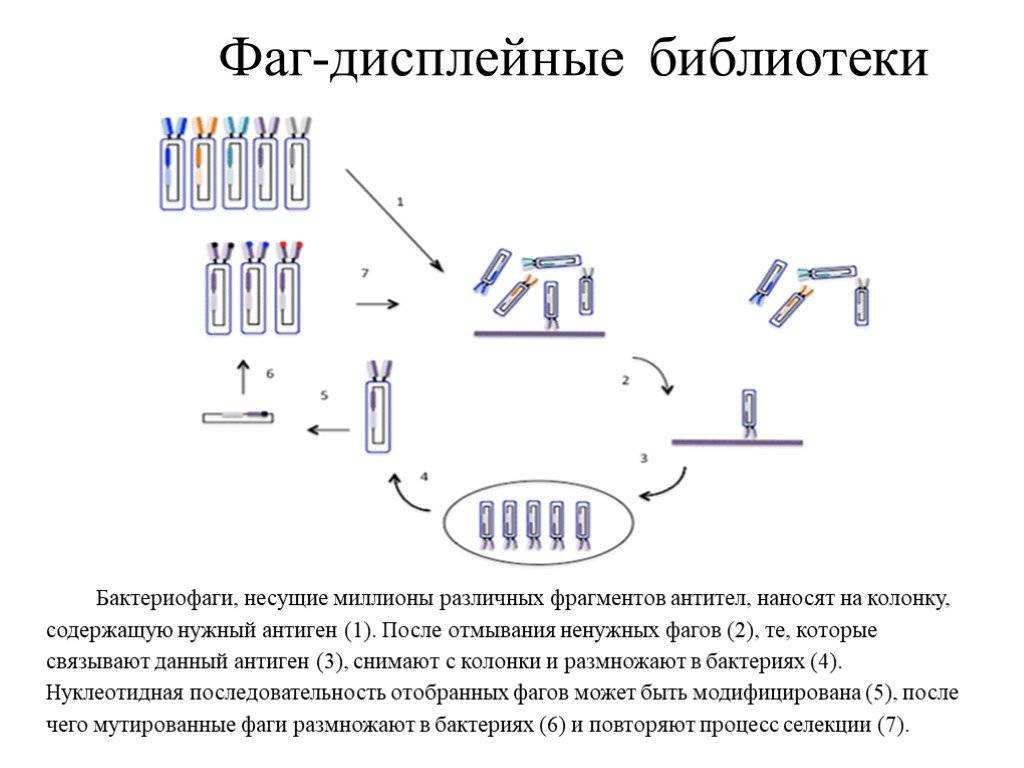
Моноклональные антитела могут быть получены по технологии рекомбинантной ДНК (рДНК), гибридомной технологии, иммортализацией B-лимфоцитов или с помощью других технологий (например, дисплей-технологии, генетически модифицированные животные).
В настоящей главе изложены принципы и общие требования к разработке, производству, установлению характеристик и спецификации препаратов моноклональных антител, которые применяются в качестве лекарственных препаратов для медицинского применения или использования в их производстве.
Что такое моноклональные антитела
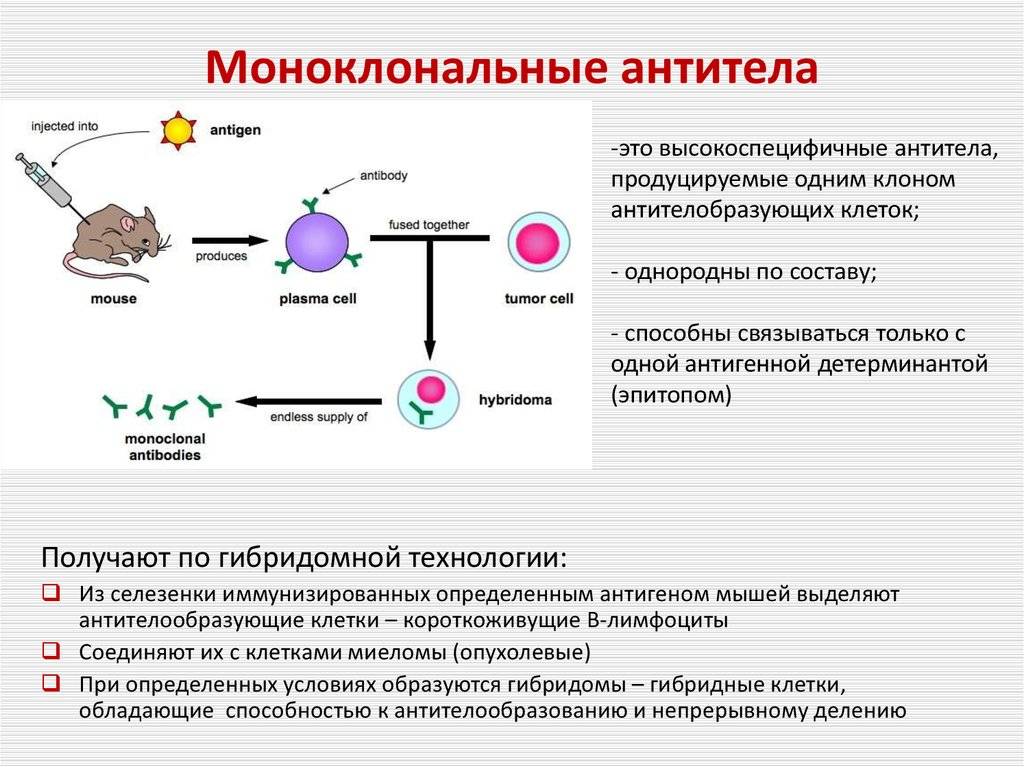
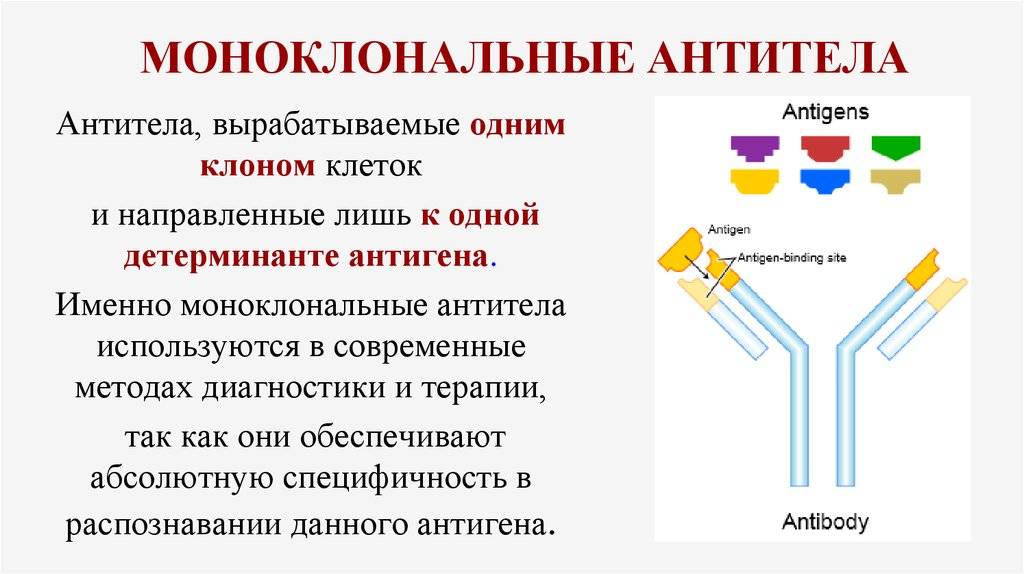
МкАТ – характерные антитела, происходящие от иммунных клеток, которые относятся к одному клеточному клону. Эти антитела имеют свойство образовываться почти против всех природных антигенов, несмотря на их специфическое связывание.
МкАТ используют для выявления именно этих компонентов и для их очистки. Ввиду того, что производство данных антител довольно сложное, их стоимость очень высока. Сегодня МкАТ активно применяются в биохимии и медицине.
Как их получают
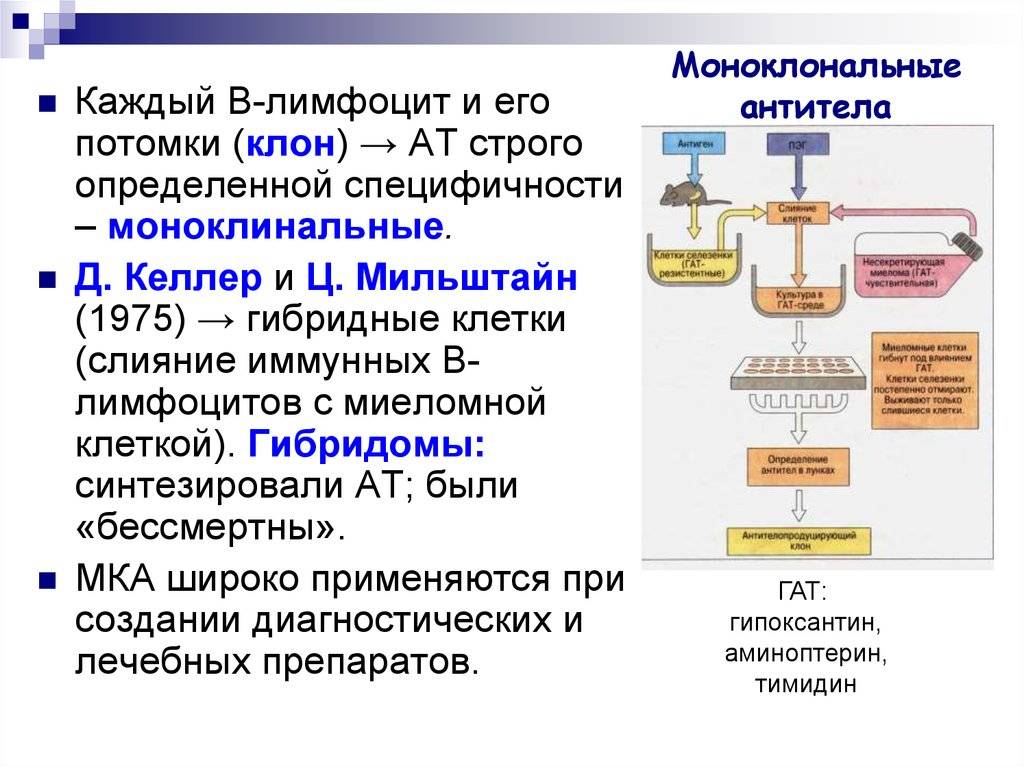
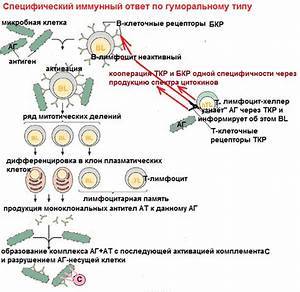
Для получения моноклональных антител ученые делают подопытным грызунам инъекции с антигеном из раковых клеток человека. Далее специалисты изымают животные клетки, которые непосредственно производят антитела и отдельно скрещивают их с раковой миеломной клеткой. В ходе этих процессов образуются совмещенные клетки — гибридомы.
Каждая клетка в процессе деления создает подобные дочерние клетки либо клоны, которые и называются «моноклональные». Антитела, создающиеся разными клонами, обязательно проверяются на умение опознавать белковые соединения плазмы крови, тесно связанных с антигеном. С помощью гибридных бессмертных клеток можно получить огромное множество антител.
Механизм действия
У каждой группы МкАТ свой принцип действия, но схожесть работы в одном – моноклоны идентифицируют определенные антигены и прикрепляются к ним. Так иммунная система быстрее реагирует на проблемы и старается избавиться от них. Проще говоря, моноклональные антитела помогают организму самостоятельно бороться с антигенами.
К еще одному немаловажному отличию МкАТ от иных антител относится способность оказывать влияние на патологически измененные клетки, не нанося ущерба здоровым. Спустя 3-4 недели лечения пациенты начинают отмечать положительную динамику
Также доказано, что при поддерживающей терапии получаемый эффект имеет довольно длительное действие. Применение препаратов, содержащих моноклоны, способствует значительному понижению гистологических проявлений недуга
Спустя 3-4 недели лечения пациенты начинают отмечать положительную динамику. Также доказано, что при поддерживающей терапии получаемый эффект имеет довольно длительное действие. Применение препаратов, содержащих моноклоны, способствует значительному понижению гистологических проявлений недуга.
Приложение
ПЕРЕЧЕНЬ ТКАНЕЙ ЧЕЛОВЕКА, РЕКОМЕНДУЕМЫХ ДЛЯ ИСПОЛЬЗОВАНИЯ В ИММУНОГИСТОХИМИЧЕСКИХ ИЛИ ЦИТОХИМИЧЕСКИХ ИССЛЕДОВАНИЯХ ПЕРЕКРЕСТНОЙ РЕАКТИВНОСТИ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ
Настоящий перечень тканей человека позволяет отразить специфичность антител в иммуногистохимических или цитохимических исследованиях перекрестной реактивности и их клиническое практическое значение и включает в себя в том числе:
- миндалину, тимус, лимфатический узел;
- костный мозг, клетки крови;
- легкие, печень, почки, мочевой пузырь, селезенку, желудок, включая подлежащие гладкие мышцы, кишечник;
- поджелудочную железу, большую слюнную железу, щитовидную железу, паращитовидную железу, надпочечник, гипофиз;
- головной мозг, периферический нерв;
- сердце, поперечнополосатую мышцу;
- яичник, яичко;
- кожу;
- кровеносные сосуды.
Получение моноклональных антител
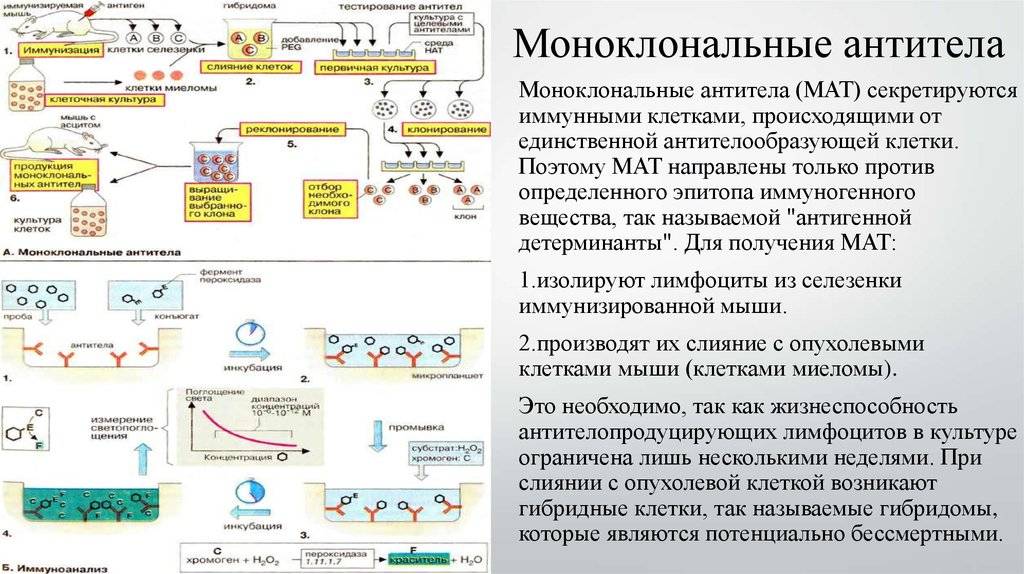
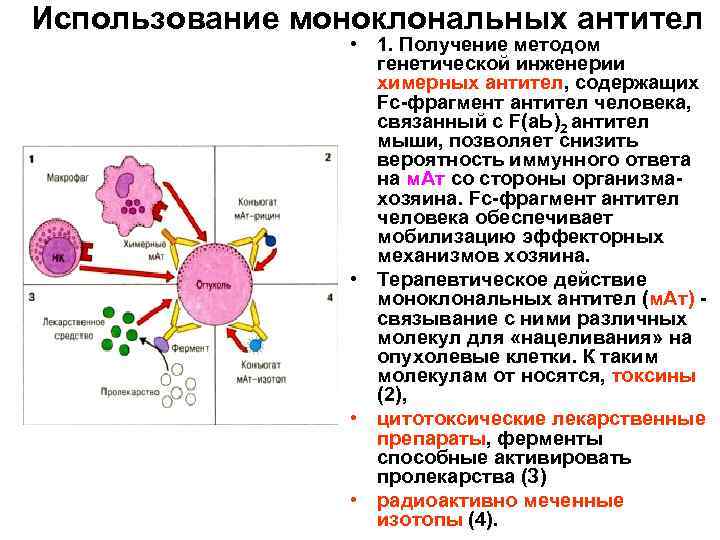
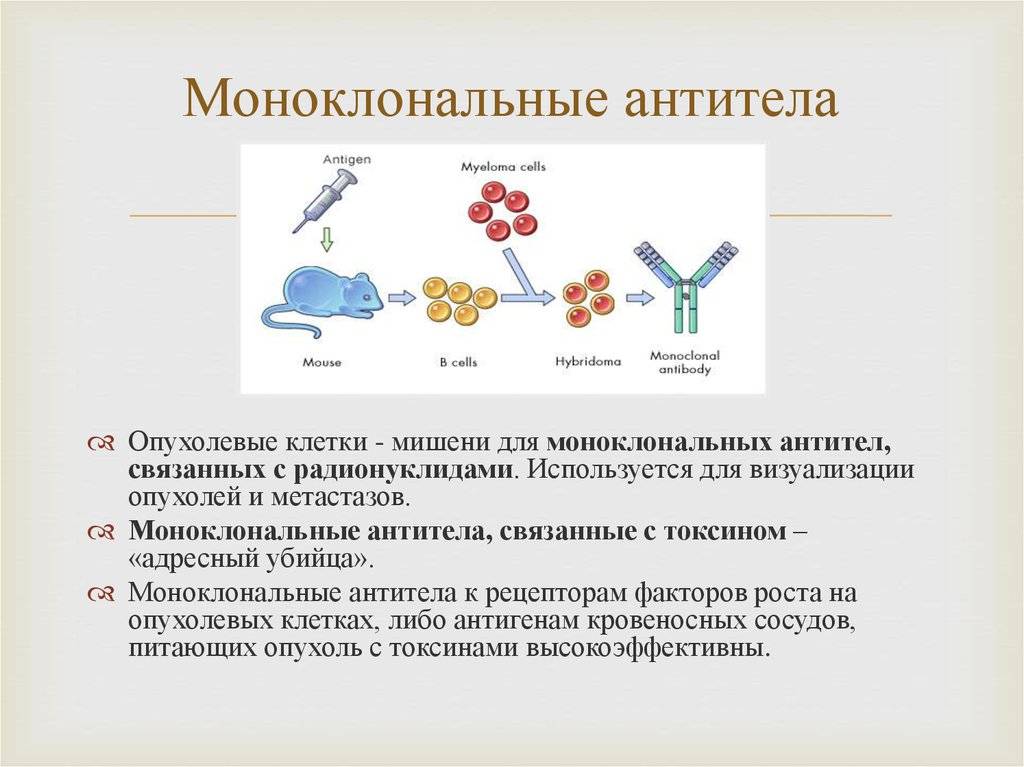
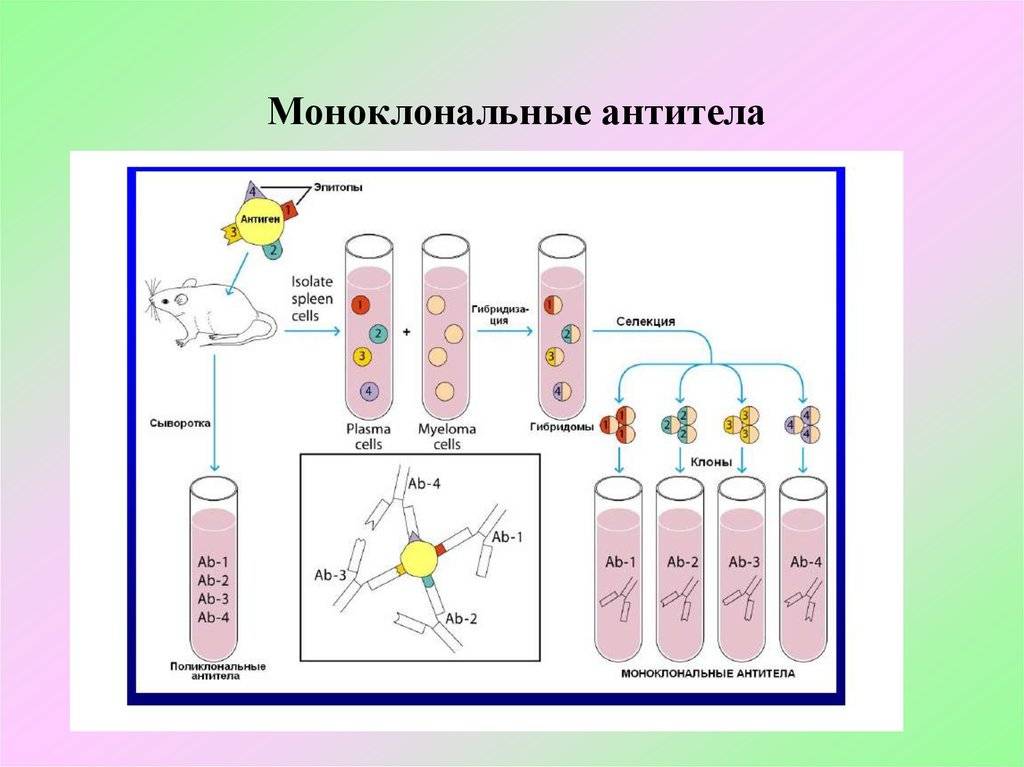
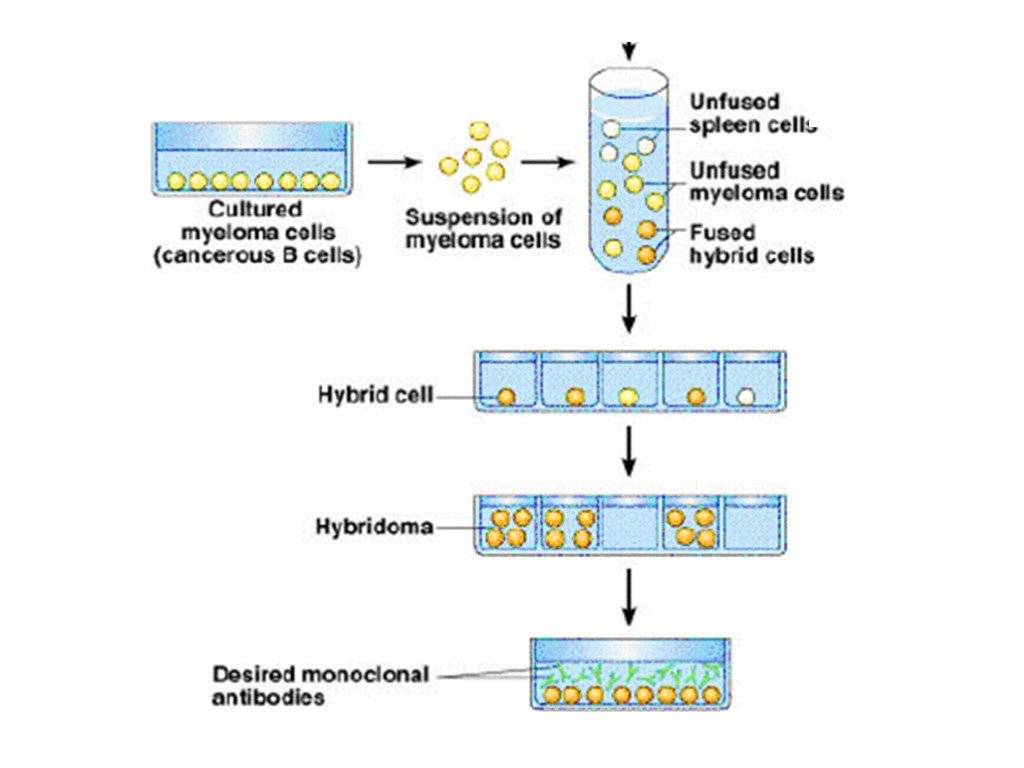
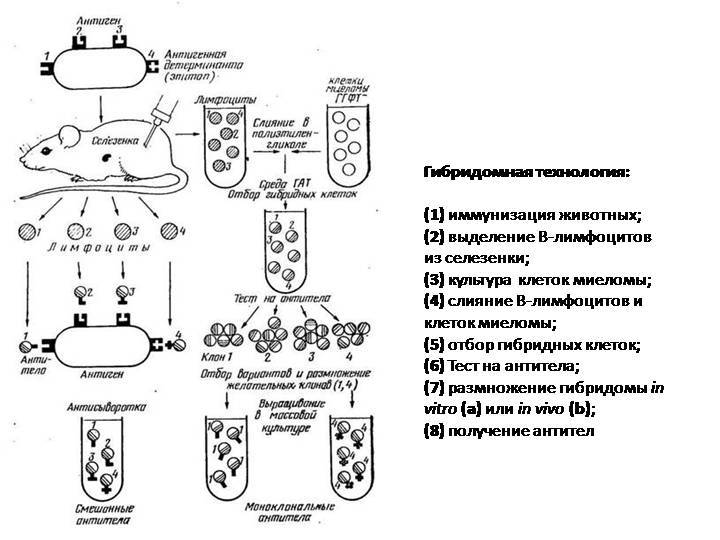
Этот процесс начинается с иммунизации животных, как правило, мышей. Для этого вводят специфический антиген, который синтезирует антитела против него. Затем у мыши удаляется селезенка и гомогенизируется для получения суспензии клеток. Она содержит B-клетки, продуцирующее антитело. Затем их смешивают с миеломой (мышиной плазмоцитомы), которая имеет непрерывную способность синтезировать себе подобных в культуре (опухолевые клоны).
Благодаря слиянию образуются гибриды опухолевых и нормальных клеток (гибридомы), непрерывно растущие и способные производить смесь антител заданной специфичности. Следующий шаг после получения гибридом — клонирование и отбор. В каждую лунку специального планшета помещают около 10 слитых клеток и культивируют их, проверяя на выработку специфических иммуноглобулинов. Гибридомы из лунок, содержащих нужные идентичные антитела (парапротеины), клонируют и вновь проверяют. Так делают 1-2 раза.
В результате получают клетки, способные производить собственные иммуноглобулины только одной нужной уникальной специфичности. Далее клоны можно заморозить и сохранять. Или же культивировать, накапливать, привить мышам, где они также будут расти. Впоследствии полученные молекулы иммуноглобулина разными методами очищаются от посторонних примесей и используются для диагностики в лабораториях или терапевтического применения.
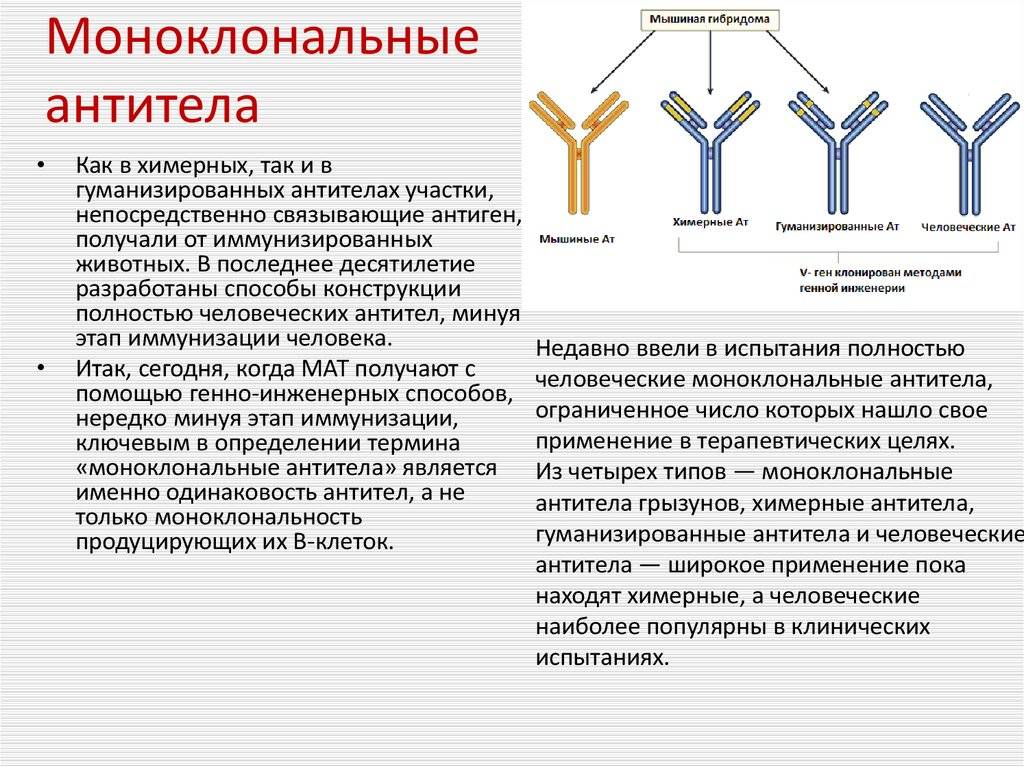
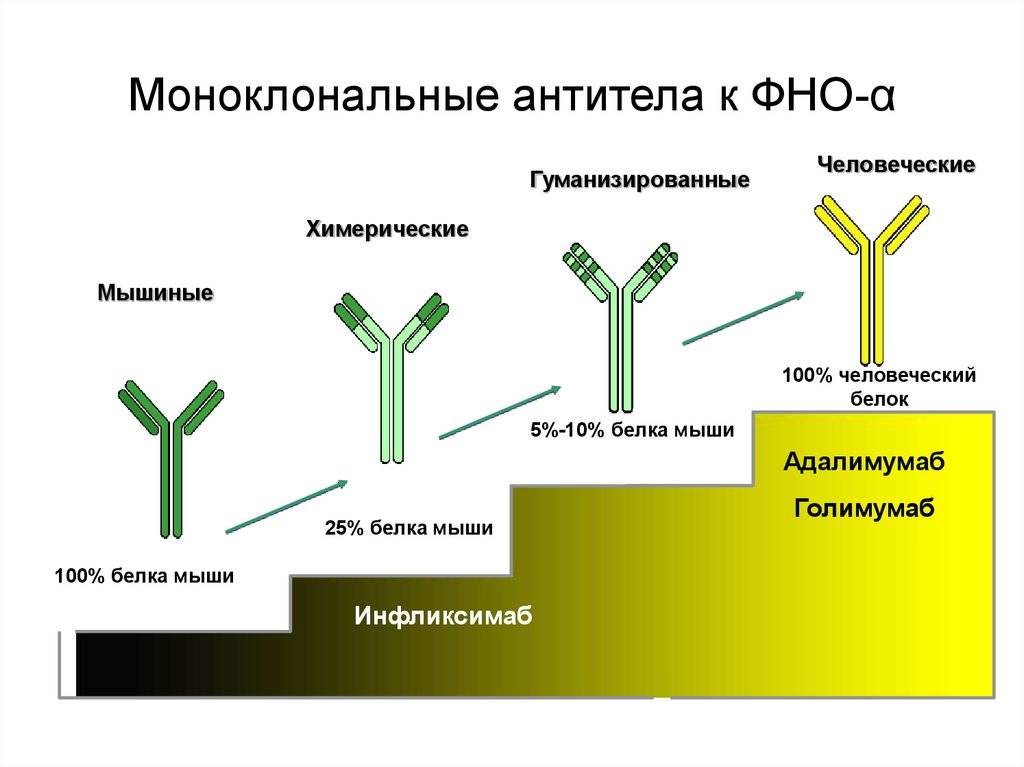
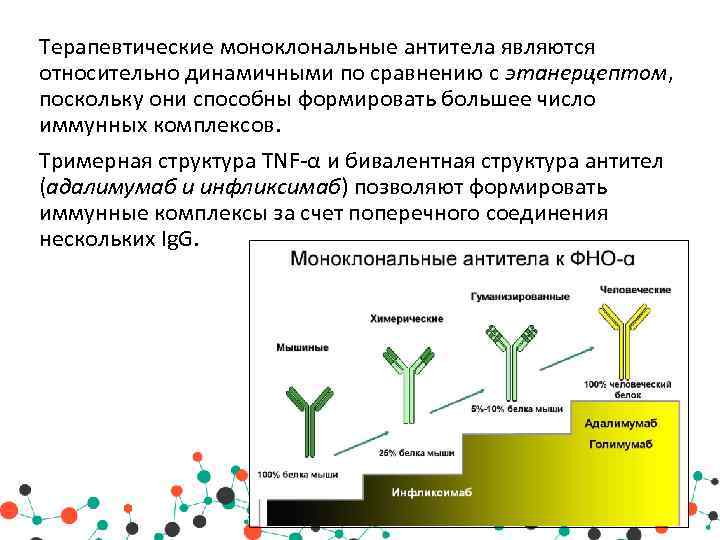
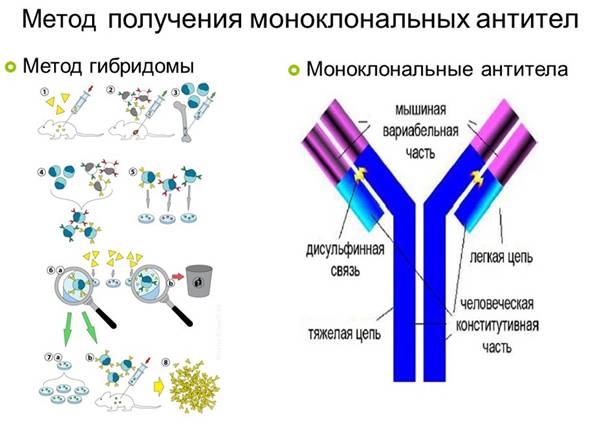
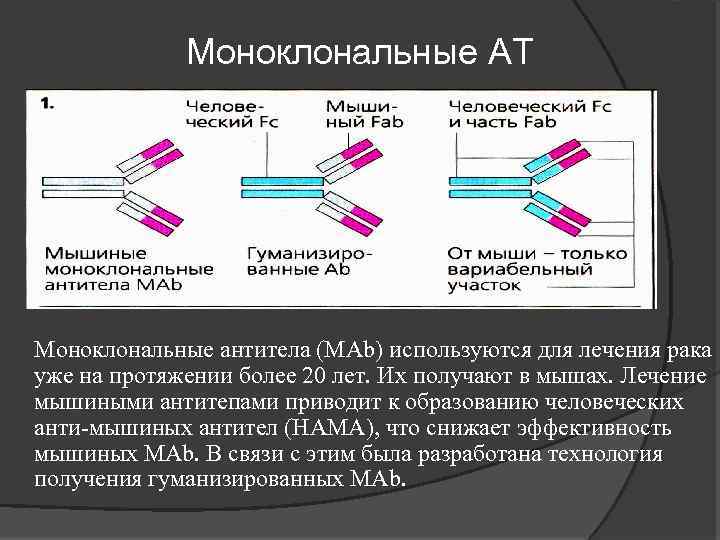
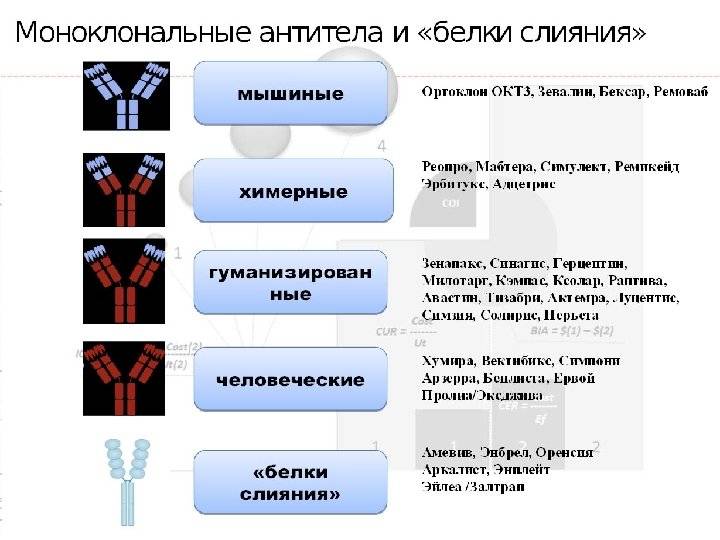
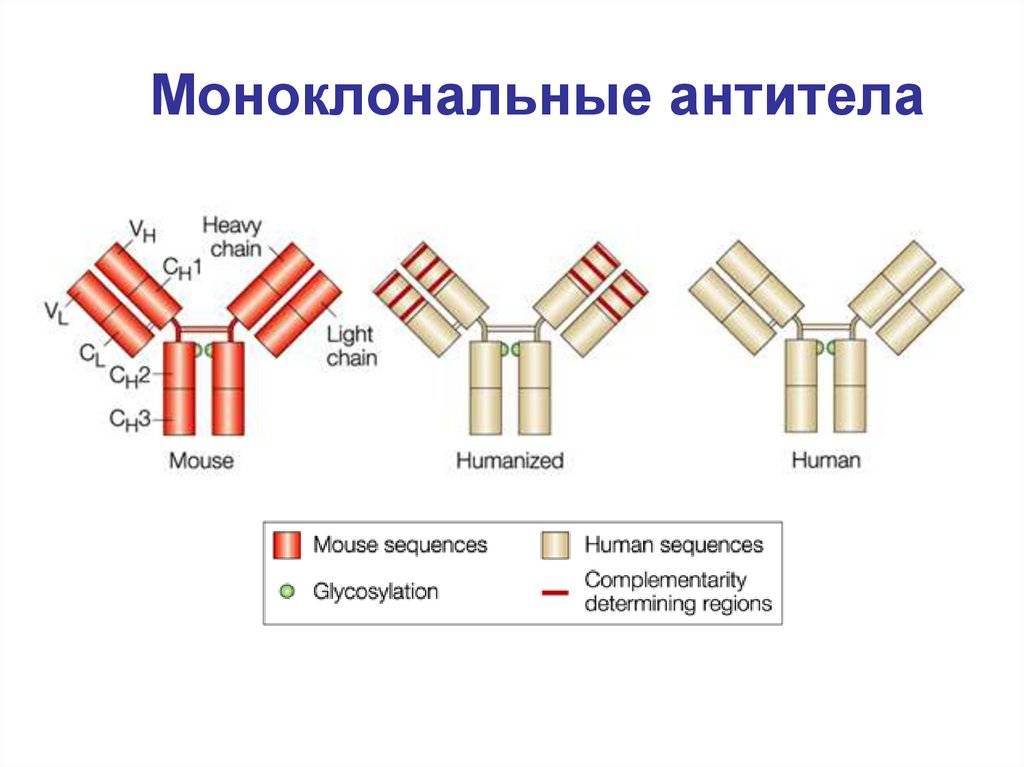
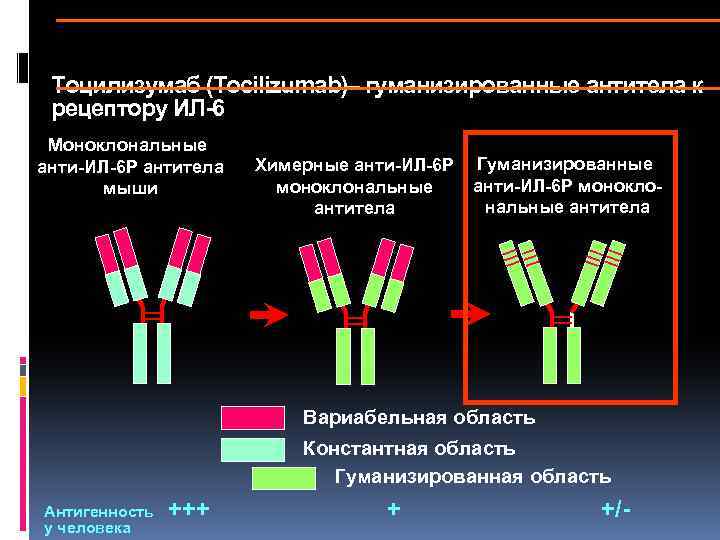
Важно отметить, что полученный с помощью гибридомы клеточный клон является мышиным иммуноглобулином, который при попадании в организм человека вызовет реакцию отторжения. Выход нашли благодаря рекомбинантным технологиям
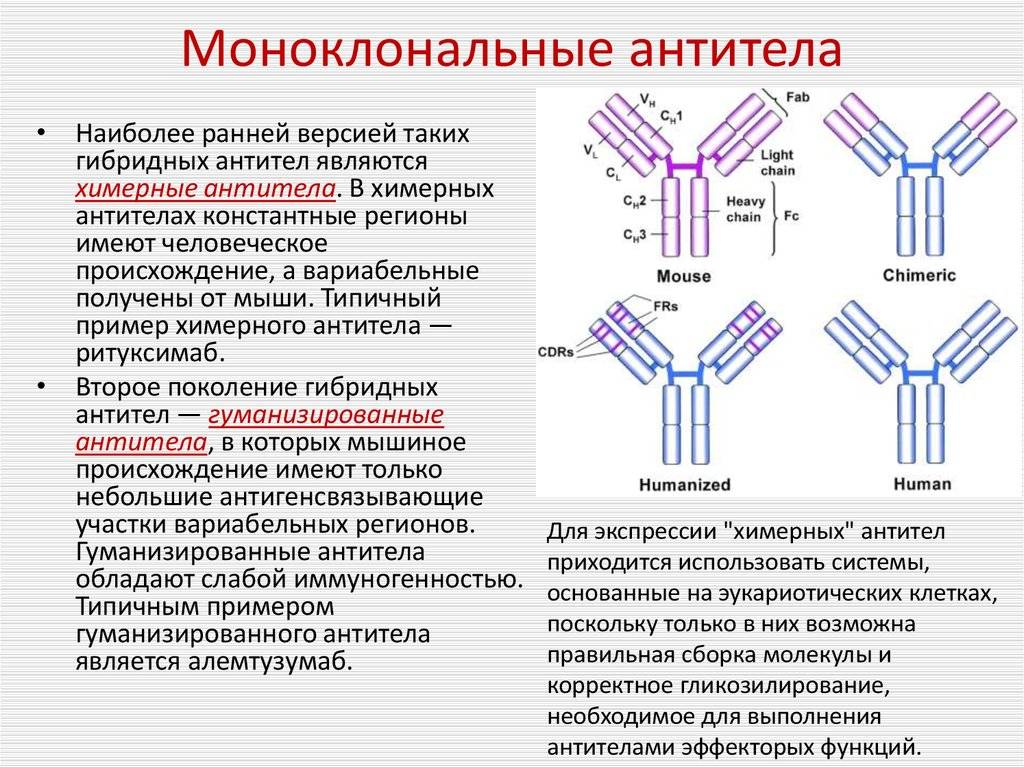
Взяв фрагмент мышиного моноклона, соединили его с фрагментом человеческого иммуноглобулина. В результате были получены гибридомы, получившие название химерных, которые были уже более близкими для человека, но все равно провоцировали иммунные реакции организма, отличающиеся от требуемых.
Следующий шаг был сделан благодаря генной инженерии и связан с созданием, так называемых гуманизированных антител, на 90% гомологичных человеческому иммуноглобулину. От первоначального гибридомного мышиного моноклона осталась лишь маленькая часть от слияния клеток, которые отвечают за специфическое связывание. Они и используются в клинических испытаниях.
История
Роль моноклональных антител была впервые высказана иммунологом начала 20 века Полем Эрлихом , который предложил идею медицинского зауберкугеля , « волшебной пули ». Это было бы соединение, которое можно было бы заставить избирательно воздействовать на болезнетворный организм, что позволило бы токсину для этого организма доставляться вместе с ним. За эту работу он и Эли Мечников были удостоены Нобелевской премии 1908 года по физиологии и медицине .
В 1970-х годах была известна множественная миелома В-клеточного рака . Было понятно, что все эти злокачественные В-клетки продуцируют один тип антител ( парапротеин ). Это было использовано для изучения структуры антител, но пока не было возможности получить идентичные антитела, специфичные к данному антигену .
Производство моноклональных антител с участием гибридных клеток человека и мыши было впервые описано Джеррольдом Швабером в 1973 году. Эта работа по-прежнему широко цитируется среди тех, кто использует гибридомы, полученные от человека .
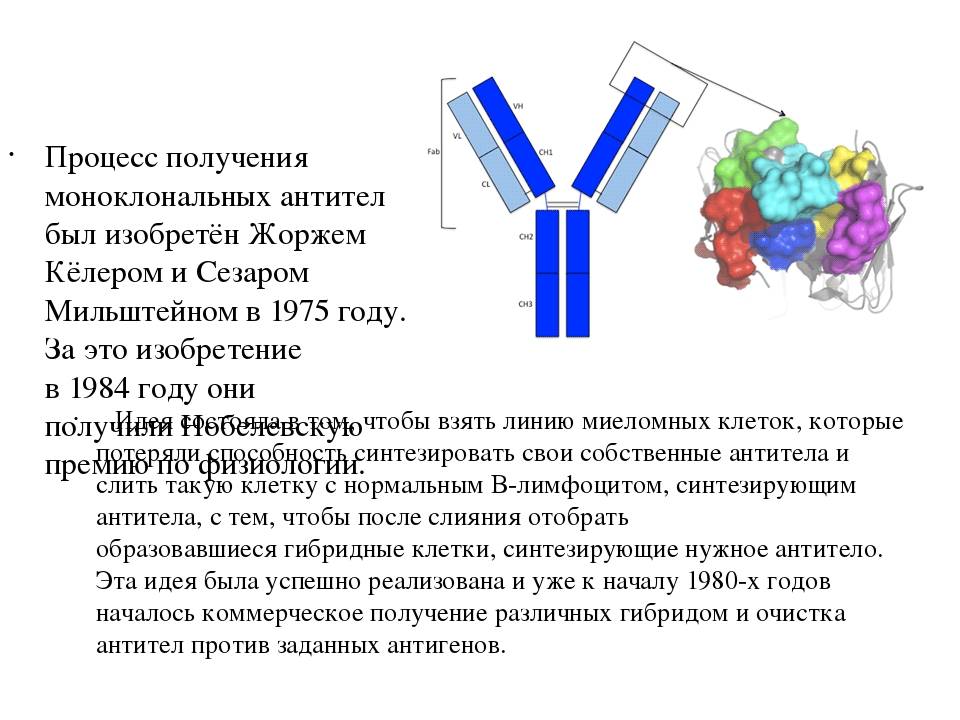
В 1975 году Жоржу Кёлеру и Сезару Мильштейну удалось осуществить слияние линий миеломных клеток с В-клетками, чтобы создать гибридомы, которые могут продуцировать антитела, специфичные к известным антигенам, и которые были увековечены. Они и Нильс Кай Йерн разделили Нобелевскую премию по физиологии и медицине в 1984 году за это открытие.
В 1988 году Грег Винтер и его команда первыми разработали методы гуманизации моноклональных антител, устраняя реакции, которые многие моноклональные антитела вызывали у некоторых пациентов.
В 2018 году Джеймс П. Эллисон и Тасуку Хондзё получили Нобелевскую премию по физиологии и медицине за открытие лечения рака путем ингибирования негативной иммунной регуляции с использованием моноклональных антител, которые предотвращают ингибирующие связи.
Примеры
1980-е
Моноклональное антитело муромонаб-CD3 , одобренное для клинического использования в 1986 году, было названо до того, как эти соглашения вступили в силу, и, следовательно, его название не следует им. Вместо этого, это сокращение от « мур ине пн oclonal NTI б Ody таргетирования CD3 ».
Конвенция до 2009 г.
- Адалимумаб — препарат, нацеленный на ФНО-альфа . Его название можно разбить на ада-лим-у-маб . Следовательно, препарат представляет собой человеческое моноклональное антитело, нацеленное на иммунную систему. Если бы адалимумаб назывался между 2009 и 2017 годами, это был бы адалумаб ( ада-л
и-у-маб ). После 2017 года это будет адалимаб ( ада-ли-маб ). - Абциксимаб — широко используемый препарат для предотвращения слипания тромбоцитов . Его название, разложенное на ab-ci-xi-mab , указывает на то, что лекарство представляет собой химерное моноклональное антитело, используемое в сердечно-сосудистой системе. Это и следующие два имени выглядели бы одинаково, если бы применялось соглашение 2009 года.
- Название лекарства от рака груди трастузумаб можно проанализировать как траст-ту-зу-маб . Следовательно, препарат представляет собой гуманизированное моноклональное антитело, используемое против опухоли.
- Алацизумаб пегол представляет собой пегилированное гуманизированное антитело, нацеленное на систему кровообращения.
- Технеций ( 99m Tc) пинтумомаб и технеций ( 99m Tc) нофетумомаб мерпентан являются радиоактивно меченными антителами, мерпентан является хелатирующим агентом, который связывает антитело нофетумомаб с радиоизотопом технеций-99m .
- Розролимупаб — поликлональное антитело . Его название, разбитое на розро-лим-у-паб , показывает, что это лекарство представляет собой поликлональное антитело человека ( -pab ), действующее на иммунную систему.
Конвенция с 2009 по 2017 год
- Оларатумаб — противоопухолевое средство . Его название состоит из компонентов олара-ту-маб . Это показывает, что препарат представляет собой человеческое моноклональное антитело, действующее против опухолей.
- В названии бенрализумаба , лекарства, разработанного для лечения астмы , есть компоненты бенра-ли-зу-маб , которые обозначают его как гуманизированное антитело, действующее на иммунную систему.
Конвенция с 2017 года
Белантамаб, мафодотин ( белан-та-маб ) также является противоопухолевым средством. Он конъюгирован с цитотоксическим агентом, который химически родственен монометилауристатину E.
Препараты с моноклональными антителами
Хотя изобретены гибриды нормальных и опухолевых клеток такого типа были не очень давно, спектр препаратов, содержащих их в своем составе, уже выглядит внушительно. Новинки фармацевтики появляются регулярно. Такие препараты, как и большинство лекарственных средств, имеют различные побочные эффекты. Нередко после применения моноклональных веществ поступают жалобы на проявление аллергических реакций в виде зуда, сыпи. Изредка терапия сопровождается тошнотой, рвотой или кишечным расстройством. Далее об эффективных препаратах подробнее.
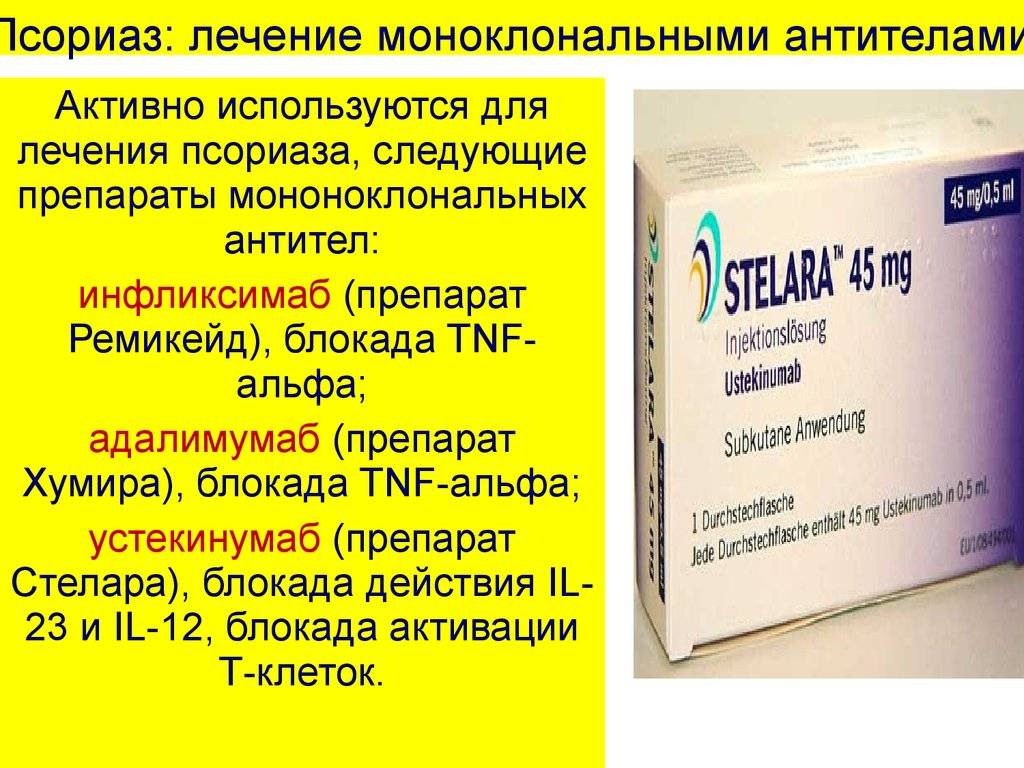
Стелара
Используется при терапии тяжелых форм бляшечного псориаза. Фармпрепарат состоит из моноклонов человека, что сводит риск возникновения побочных эффектов к минимуму. Форма выпуска – раствор для подкожного введения во флаконе или в шприце. Рекомендованная дозировка составляет 45 мг в сутки. Вторую инъекцию вводят через 4 недели после первой, далее уколы делают 1 раз в 12 недель. Терапевтический эффект от Стелара проявится уже через 15-20 дней. Поддерживающее лечение обеспечивает продолжительность ремиссии. После 2 инъекций кожа очищается на 75%.
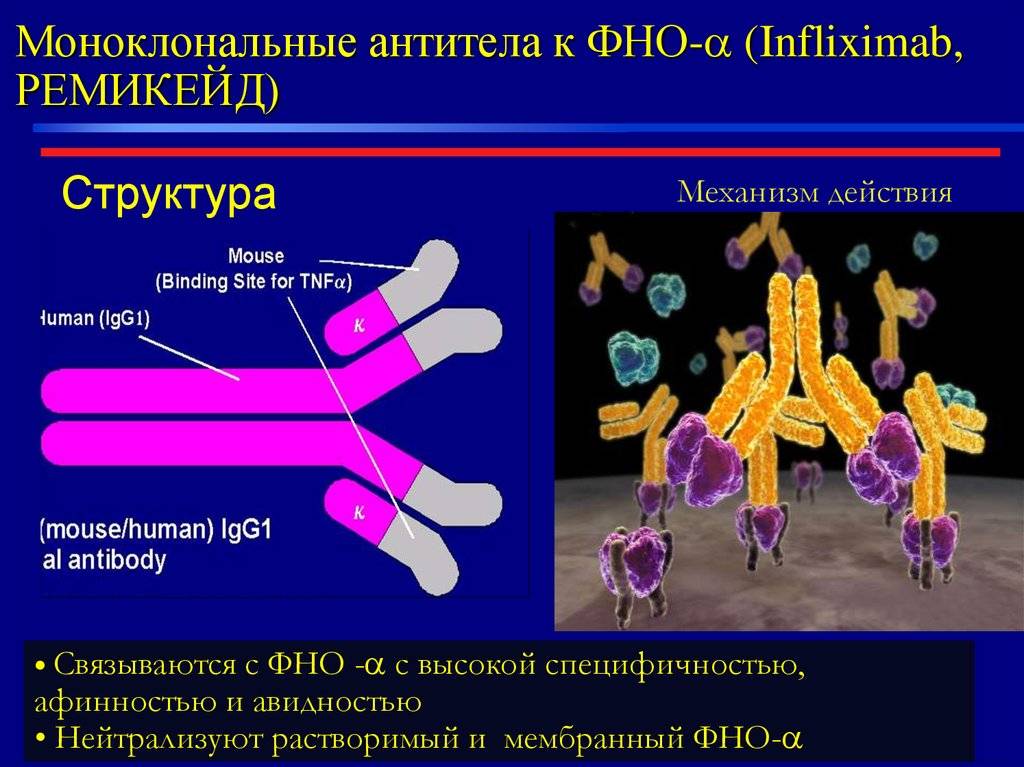
Ремикейд
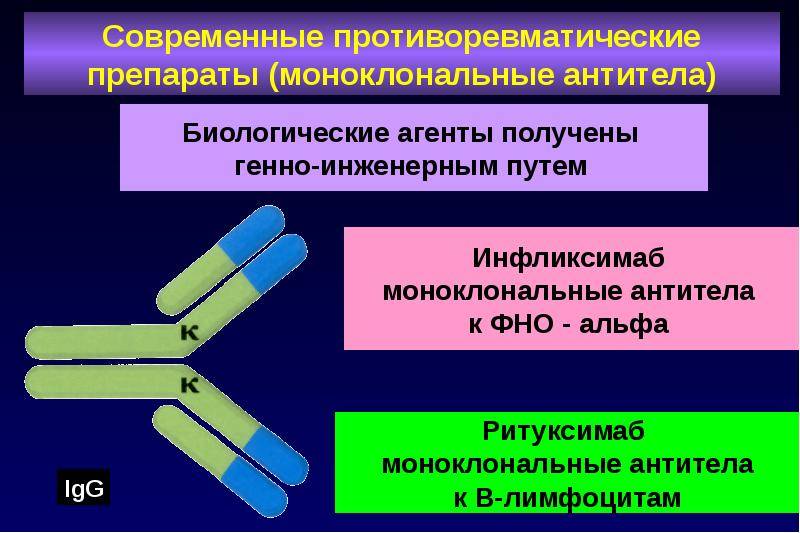
Представляет собой химерные антитела на основе моноклонов мыши и человека. Препарат снижает воспаление эпидермиса, регулирует деление кожных клеток. Форма выпуска – порошок лиофилизированный для приготовления парентерального раствора или во флаконах 20 мл. Состав для инфузий вводят внутривенно на протяжении 2-х часов со скоростью до 2 мл в минуту. Дозировка зависит от степени тяжести болезни. Повторные инъекции делают через 2 и 6 недель после первой. Для поддержки эффекта терапию повторяют каждые 1,5-2 месяца.
Хумира
Рекомбинантный моноклон с пептидной последовательностью, идентичной человеческой. Препарат эффективен при терапии сложных форм псориаза, тяжелом активном ревматоидном и псориатическом артрите. Применяется в виде подкожных инъекций в область живота или переднюю бедренную поверхность. Форма выпуска – раствор для подкожного введения. Уколы по 40 мг вводятся 1 раз в 2 недели.
Симпони
Составляющие фармпрепарата — моноклоны человека. Применяется при прогрессирующем псориатическом или ревматоидном артрите, анкилозирующем спондилите. Это средство помогает уменьшить симптомы при псориазе ногтей и кожи. Форма выпуска – раствор для подкожных инъекций (шприц или автоинжектор). Симпони требуется вводить подкожно один раз в месяц.

Стоимость
Mab дороже в производстве, чем небольшие молекулы из-за сложных процессов и общего размера молекул, и все это в дополнение к огромным затратам на исследования и разработки, связанным с предоставлением пациентам нового химического соединения. Цены на них позволяют производителям окупить, как правило, большие инвестиционные затраты, а там, где нет контроля над ценами, например в США, цены могут быть выше, если они обеспечивают большую ценность. Семь исследователей из Университета Питтсбурга пришли к выводу: «Ежегодная цена терапии с применением mAb примерно на 100 000 долларов выше в онкологии и гематологии, чем при других болезненных состояниях», сравнивая их на уровне пациента с ценами на сердечно-сосудистые или метаболические нарушения, иммунологию, инфекционные заболевания. аллергия и офтальмология.
Механизм образования и работы
 Заключительный этап производства — выращивания культур в биореакторах.
Заключительный этап производства — выращивания культур в биореакторах.
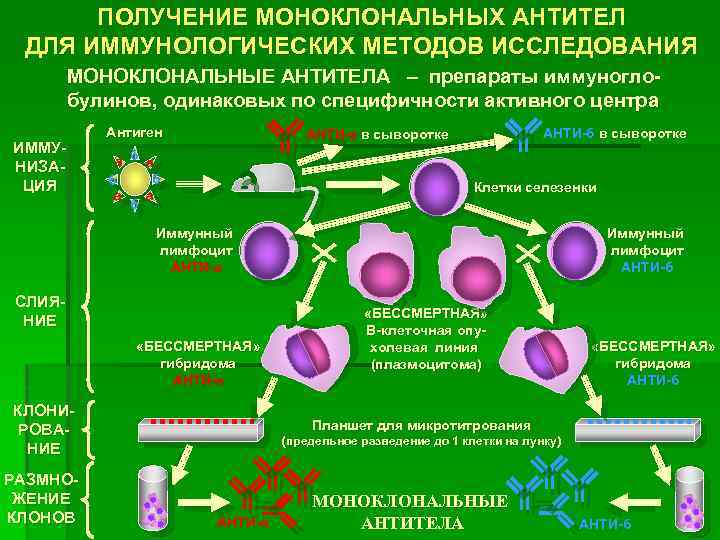
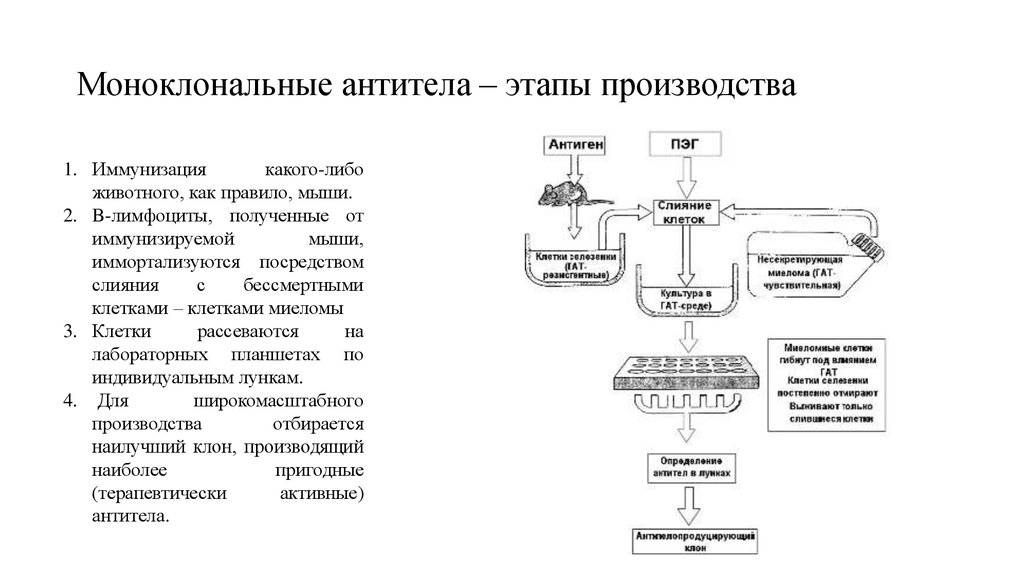
Создание моноклональных антител включает следующие этапы:
- Мышей (или других животных, которые подходят для этой процедуры), иммунизирует путем введения чужеродного вещества — антигена.
- Спустя несколько недель, проверяют у них появление иммунного ответа. О нем свидетельствует появление антител к введенному антигену.
- Если результат положительный, у мышей препарируют селезенку и готовят ее к забору клеток. Для этого орган измельчают, предварительно промыв в дистиллированной воде. В специальном аппарате производится встряхивание создавшейся массы для отделения клеток, которые понадобятся в итоге.
- Среди клеточного гомогенизата находят Т- или B-лимфоциты, от которых ожидается продукция нужных антител.
- Эти клетки перемешивают с вытяжкой, содержащей клетки спинного мозга, пораженного опухолью (миеломные). Их способность мутировать активизирует B-лимфоциты.
- В полученную суспензию добавляют ферменты и инкубируют ее в определенных химических реактивах.
- Образовавшиеся гибридные клетки выращивают на питательных средах.
- С помощью иммуноферментного анализа проверяют способность новосозданных клеточных структур выполнять свою функцию.
- Отобранные клоны клеток замораживают. Они готовы к употреблению в лечебных целях.
Менее распространенными методиками приготовления моноклональных антител является их выращивание непосредственно в теле мыши, встраивание частички гена иммунных клеток человека в генотип вируса, поражающего бактерии (бактериофага), и дальнейшие генноинженерные манипуляции. Все МАТ имеют сходные механизмы работы. Заключаются они в поиске конкретных антигенов, вызывающих заболевание и обезвреживании их.
64 Методы приготовления и применения агглютинирующих, адсорбированных сывороток.
В диагностике
инфекционных болезней широко применяются
иммунные реакции при идентификации
возбудителя: при установлении родовой,
видовой и типовой принадлежности микроба
(вируса). Для постановки таких реакций
необходимы специфические диагностические
сыворотки, которые в зависимости от
содержания соответствующих антител
называются агглютинирующие, преципитирующие,
гемолитические, противовирусные.
Агглютинирующие
сыворотки. Агглютинирующую сыворотку
получают иммунизацией кроликов
(внутривенно, подкожно или внутрибрюшинно)
взвесью убитых бактерий, начиная с дозы
200 млн., затем 500 млн., 1 млрд., 2 млрд.,
микробных тел в 1 мл, с интервалами 5
дней. Через 7—8 дней после последней
иммунизации берут кровь и определяют
титр антител. Титром агглютинирующей
сыворотки называется то максимальное
разведение сыворотки, при котором
происходит агглютинация с соответствующим
микроорганизмом.
Агглютинирующие
сыворотки применяются при идентификации
микроба в развернутой реакции агглютинации.
Если изучаемый микроорганизм
агглютинируется сывороткой до титра
или до половины значения титра, его
можно считать принадлежащим к тому
виду, название которого указано на
этикетке ампулы.
Неадсорбированные
агглютинирующие сыворотки обладают
высоким титром — до 1 : 12 800 — 1 : 25 600.
Недостатком
таких сывороток является то, что они
способны давать групповые реакции
агглютинации, так как они содержат
антитела к бактериям, имеющим общие
антигены в пределах семейства, группы
и рода.
Поэтому в
настоящее время большинство агглютинирующих
сывороток выпускаются адсорбированными,
монорецепторными и адсорбированными
поливалентными, содержащими только
типовые или видовые антитела и
соответствующими или определенному
типу или виду микроорганизма. Эти
сыворотки не подлежат разведению.
Для получения
таких сывороток применяют метод
Кастелляни — метод адсорбции, который
состоит в том, что при насыщении
агглютинирующей сыворотки родственными
гетерогенными бактериями происходит
адсорбция групповых антител, а
специфические антитела остаются в
сыворотке. В зависимости от полноты
истощения групповых агглютининов
можно получить монорецепторные сыворотки
— сыворотки, имеющие антитела только
к одному рецептору-антигену или
адсорбированные, поливалентные, дающие
реакции агглютинации с двумя — тремя
родственными бактериями, имеющими
общий антиген, в отношении которого
проводилась адсорбция.
Адсорбированные
сыворотки применяют при идентификации
выделенных возбудителей в реакции
агглютинации на стекле (пластинчатый
метод).
Агглютинирующие
сыворотки наиболее широко применяются
при диагностике заболеваний, вызываемых
бактериями семейства Enterobacteriaceae. Так,
при идентификации эшерихий используются
поливалентные и типовые ОК-сыворотки;
при дифференциации сальмонелл — набор
сывороток: агглютинирующая
адсорбированная поливалентная
сальмонеллезная О-сыворотка (групп А,
В, С, Д, Е) — для определения принадлежности
к роду Salmonella, при положительном результате
— определяют отдельно с каждой сывороткой
(входящей в смесь) серологическую
группу и в заключение определяется
серологический тип выделенного
возбудителя с моно-рецепторными
Н-сыворотками сальмонелл, входящих в
данную группу.
Механизм действия моноклоналных антител
Моноклональные антитела широко используются в лечении заболеваний, у которых в патогенезе замешан иммунный компонент. С их помощью лечат псориаз, аутоиммунные заболевания, ревматоидный артрит, рассеянный склероз. Большие перспективы эти технологии получили и в онкологии в рамках таргетной терапии. При этом, их эффект основан на различных механизмах, которые рассмотрены ниже.

Изменение клеточных сигналов
В качестве примера изменения клеточных сигналов можно привести рецепторы факторов роста. Некоторые злокачественные клетки имеют на своей поверхности большое количество рецепторов к факторам роста, активирующим каскад реакций, направленный на усиление размножения клетки. Чем больше таких рецепторов, тем активнее протекает этот процесс. Если блокировать рецептор с помощью моноклонального антитела, он не сможет связаться с лигандом (фактором роста), и соответственно каскад этих реакций не будет запущен. Клетка не будет так активно размножаться и в конце концов погибнет.
Комплемент-зависимая цитотоксичность
Этот механизм реализуется следующим образом. Антитело связывается с антигеном, находящимся на поверхности злокачественной клетки, что приводит к активации многоэтапной системы комплемента (механизма иммунного ответа). Конечным этапом этих реакций является образование особого белка С 9, который перфорирует клеточную мембрану раковой клетки, что в конечном итоге приводит к ее гибели.
Усиление цитотоксического воздействия иммунных клеток
Моноклональные антитела могут стимулировать иммунные клетки, например, макрофаги. Они будут распознавать клетки злокачественных опухолей и «пожирать» их, тем самым уничтожая их.
Развитие адаптивного иммунитета
Одной из причин, по которой становится возможным образование и развитие злокачественной опухоли в организме, является то, что иммунная система человека не распознает такие клетки как чужеродные. Моноклональные антитела дают возможность иммунитету «познакомиться» с раком и делает его доступным для связывания и последующего уничтожения. Таким образом, организм получает возможность самостоятельно бороться с опухолью.
Препараты с моноклональными антителами
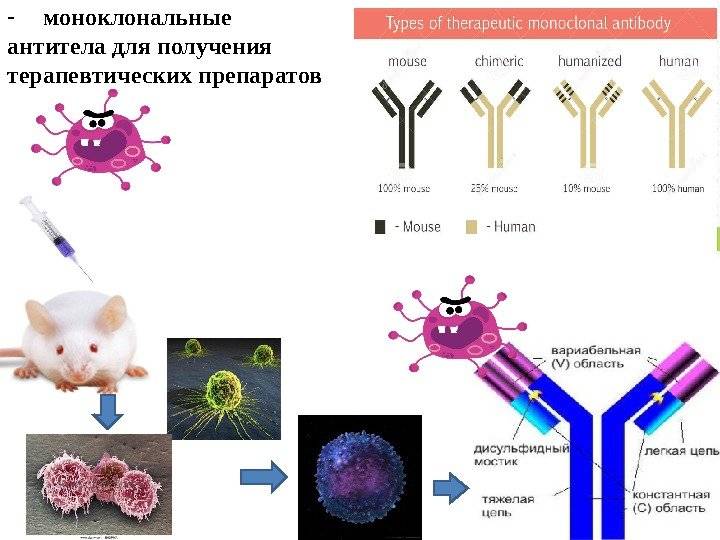
Препараты на основе моноклональных антител уже два десятилетия входят в протоколы противоопухолевого лечения некоторых злокачественных новообразований. В 2008 году ВОЗ были приняты рекомендации относительно непатентованных названий таких препаратов:
- Их название должно заканчиваться на маб, от английского monoclonal antibody.
- Для указания источника получения моноклонального антитела должны использоваться следующие подосновы:
-
- -аксо — гибридное антитело.
- -о — мышиное антитело.
- -кси — химерное антитело.
- -у — человеческое антитело.
В настоящее время используется два вида противоопухолевых моноклональных антител:
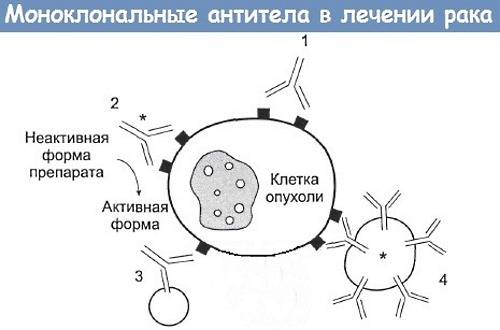
- Неконъюгированные антитела — они оказывают непосредственное действие на процессы, которые приводят к гибели злокачественной клетки.
- Конъюгированные антитела — они связаны (конъюгированы) с токсинами или изотопами. Токсины и изотопы обладают уничтожающим действием на злокачественные клетки, а антитело обеспечивает их прицельную доставку к клеткам-мишеням.
Применение неконъюгированных антител
Эти препараты используются чаще всего. Их целью является определенный рецептор на поверхности злокачественной клетки.
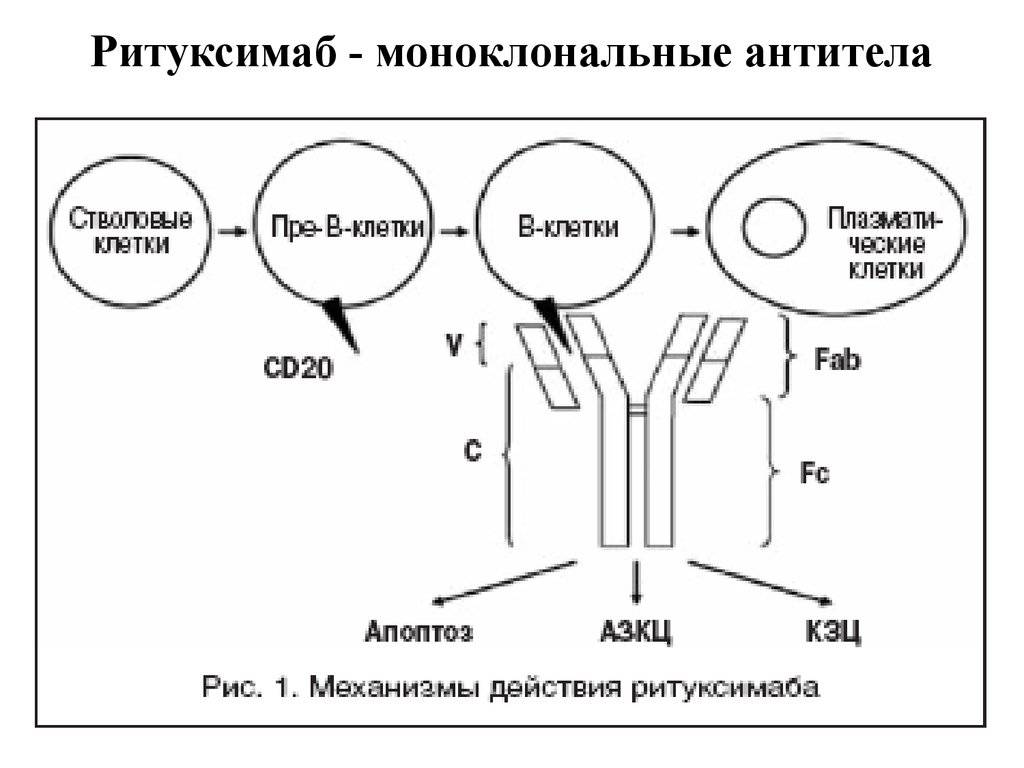
К этому типу препаратов относится ритуксимаб — первое моноклональное антитело, которое было одобрено для применения в клинической практике. Его используют для лечения CD20+ В-клеточных лимфом. Рецептор CD20 есть на В-лимфоцитах, как здоровых, так и опухолевых, но он отсутствует на других тканях и клетках, в том числе на стволовых. Поэтому при воздействии ритуксимаба хоть и погибает популяция В-лимфоцитов, но потом она восстанавливается за счет нетронутых стволовых клеток. Причем восстанавливаются именно здоровые клетки.
Неконъюгированные антитела могут помечать злокачественные клетки и делать их видимыми для иммунной системы
Таким способом работает алемтузумаб, который связывается с CD52+ лимфоцитами и привлекает к ним внимание иммунитета
Также к неконъюгированным моноклональным антителам относятся ингибиторы рецепторов факторов роста. Факторы роста — это специальные молекулы, которые запускают деление клетки. Для того чтобы запустить этот процесс, фактор должен связаться со специальным рецептором, расположенным на мембране клетки, что приведет к каскаду соответствующих реакций. Такие рецепторы есть и у здоровых клеток, и у злокачественных, но у злокачественных их может быть очень много, что позволяет таким клеткам делиться быстрее. Блокирование рецепторов с помощью антител приводит к нарушению этого процесса деления и клетки уже не могут бесконтрольно размножаться. К таким препаратам относится трастузумаб, цетуксимаб и др.
К неконъюгированным антителам относятся и ингибиторы ангиогенеза — образования кровеносных сосудов. Ангиогенез очень важен для злокачественных опухолей, чтобы получать большее количество кислорода и питательных элементов, поэтому опухоли инциируют его образование с помощью специальных химических сигналов. Моноклональные антитела либо блокируют передачу этих сигналов, либо разрушают уже созданную внутри опухоли сосудистую сеть. Это приводит к нарушению ее питания и остановке роста. К группе этих препаратов относится рамуцирумаб, бевацизумаб и др.
Применение конъюгированных антител
Конъюгированные моноклональные антитела связывают с цитотоксическими или радиотоксическими веществами, что позволяет прицельно воздействовать разрушающим агентом на злокачественные клетки. В качестве примера такого препарата можно привести ибритумомаб (Зевалин), в котором моноклональное антитело против CD20 (как мы помним, это маркер В-лимфоцитов) соединено с радиоактивным изотопом — иттрием-90. Препарат применяется для лечения В-клеточных лимфом. В качестве другого препарата можно привести Кадсилу — препарат, в котором антитело трастузумаб конъюгировано с ингибитором микротрубочек DM1, оказывающим цитотоксический эффект. Применяют его для лечения рака молочной железы.
Приложения
Диагностические тесты
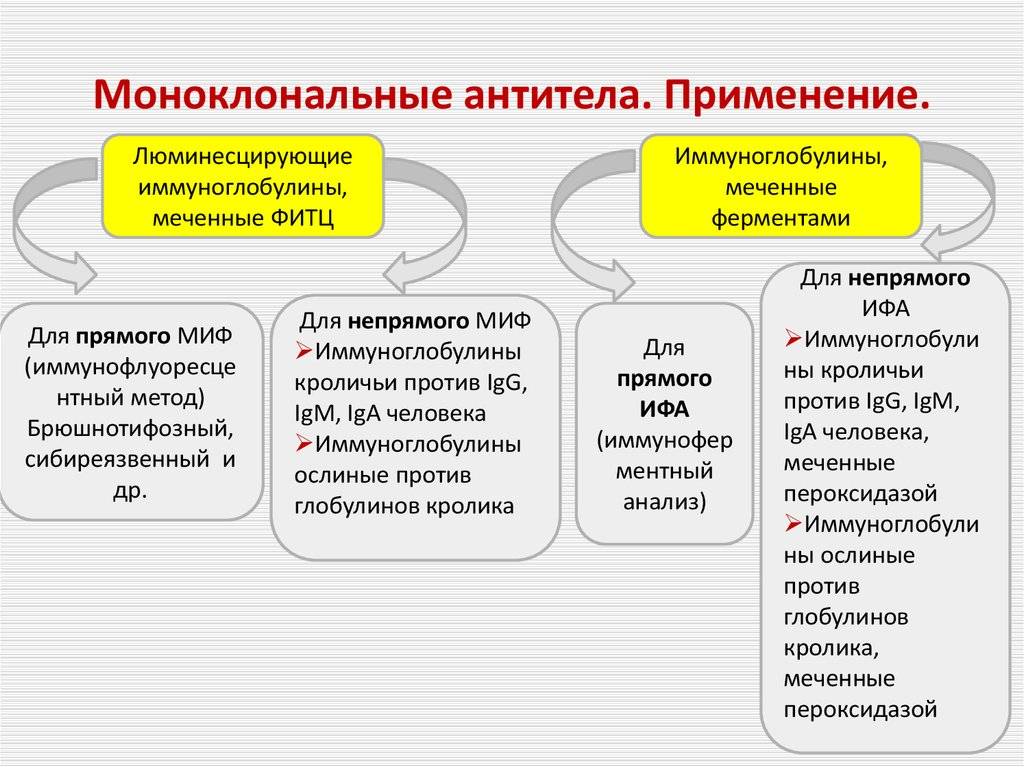
После того, как моноклональные антитела к данному веществу были произведены, их можно использовать для обнаружения присутствия этого вещества. Белки можно обнаружить с помощью тестов вестерн-блоттинга и иммунодот- блоттинга . В иммуногистохимии моноклональные антитела можно использовать для обнаружения антигенов в фиксированных срезах ткани, и аналогично иммунофлуоресценция может использоваться для обнаружения вещества либо в замороженных срезах ткани, либо в живых клетках.
Аналитическое и химическое использование
Антитела также можно использовать для очистки их целевых соединений от смесей, используя метод иммунопреципитации .
Терапевтическое использование
Терапевтические моноклональные антитела действуют посредством множества механизмов, таких как блокирование функций молекул-мишеней, индукция апоптоза в клетках, экспрессирующих мишень, или путем модуляции сигнальных путей.
Лечение рака
Одно из возможных методов лечения рака включает моноклональные антитела, которые связываются только с антигенами, специфичными для раковых клеток, и вызывают иммунный ответ против целевой раковой клетки. Такие mAb можно модифицировать для доставки токсина , радиоизотопа , цитокина или другого активного конъюгата или для создания биспецифических антител, которые могут связываться с их участками Fab как с целевым антигеном, так и с конъюгатом или эффекторной клеткой. Каждое интактное антитело может связываться с клеточными рецепторами или другими белками своей Fc-областью .
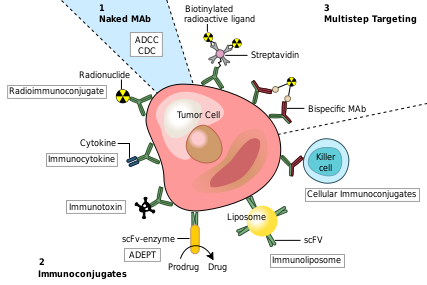 Моноклональные антитела против рака. ADEPT , ферментная пролекарственная терапия, направляемая антителами; ADCC : антителозависимая клеточно-опосредованная цитотоксичность; CDC: комплемент-зависимая цитотоксичность ; MAb: моноклональное антитело; scFv, одноцепочечный фрагмент Fv.
Моноклональные антитела против рака. ADEPT , ферментная пролекарственная терапия, направляемая антителами; ADCC : антителозависимая клеточно-опосредованная цитотоксичность; CDC: комплемент-зависимая цитотоксичность ; MAb: моноклональное антитело; scFv, одноцепочечный фрагмент Fv.
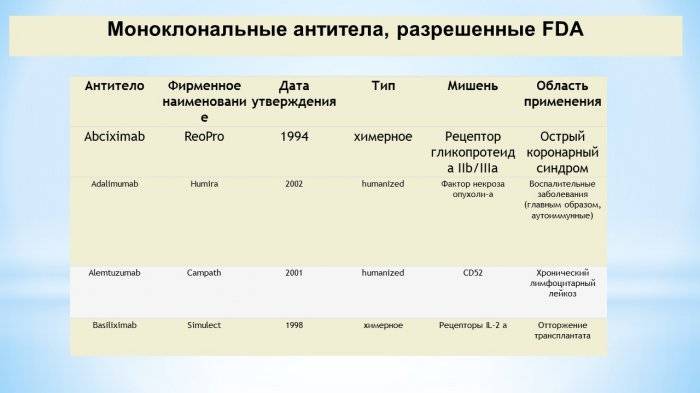
МАТ, одобренные FDA для лечения рака, включают:
- Алемтузумаб
- Бевацизумаб
- Цетуксимаб
- Гемтузумаб озогамицин
- Ипилимумаб
- Офатумумаб
- Панитумумаб
- Пембролизумаб
- Ранибизумаб
- Ритуксимаб
- Трастузумаб
Аутоиммунные заболевания
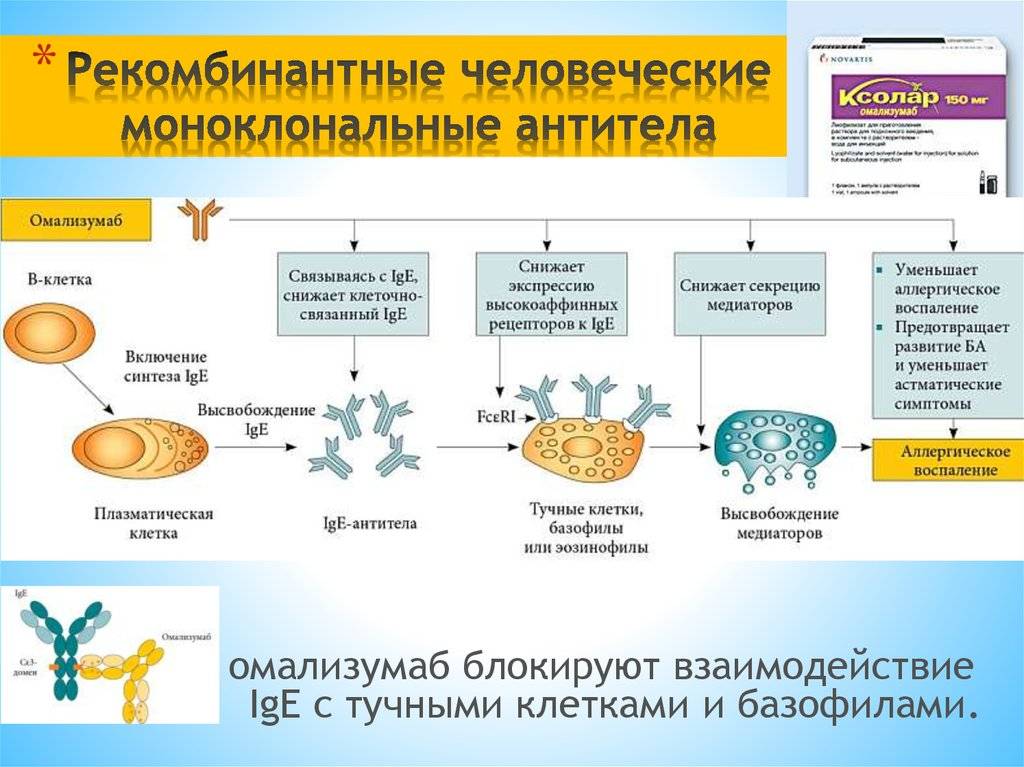
Моноклональные антитела, используемые при аутоиммунных заболеваниях, включают инфликсимаб и адалимумаб , которые эффективны при ревматоидном артрите , болезни Крона , язвенном колите и анкилозирующем спондилите благодаря своей способности связываться с TNF-α и ингибировать его . Базиликсимаб и даклизумаб ингибируют IL-2 на активированных Т-клетках и тем самым помогают предотвратить острое отторжение трансплантатов почек. Омализумаб ингибирует человеческий иммуноглобулин Е (IgE) и полезен при лечении аллергической астмы средней и тяжелой степени .
Примеры терапевтических моноклональных антител
Моноклональные антитела для исследовательских целей можно найти непосредственно у поставщиков антител или с помощью специальной поисковой системы, такой как CiteAb . Ниже приведены примеры клинически важных моноклональных антител.
| Главная категория | Тип | заявка | Механизм / цель | Режим |
|---|---|---|---|---|
| Анти- воспалительное | инфликсимаб |
|
ингибирует TNF-α | химерный |
| адалимумаб |
|
ингибирует TNF-α | человек | |
| базиликсимаб | ингибирует IL-2 на активированных Т-клетках | химерный | ||
| даклизумаб | ингибирует IL-2 на активированных Т-клетках | очеловеченный | ||
| омализумаб | ингибирует человеческий иммуноглобулин E (IgE) | очеловеченный | ||
| Противораковые | гемтузумаб | нацеливает миелоидный клеточный поверхностный антиген CD33 на лейкозные клетки | очеловеченный | |
| алемтузумаб | нацеливает антиген CD52 на Т- и В-лимфоциты | очеловеченный | ||
| ритуксимаб |
|
нацеливает фосфопротеин CD20 на В-лимфоциты | химерный | |
| трастузумаб | нацелен на рецептор HER2 / neu (erbB2) | очеловеченный | ||
| нимотузумаб |
|
Ингибитор EGFR | очеловеченный | |
| цетуксимаб | Ингибитор EGFR | химерный | ||
| бевацизумаб и ранибизумаб | ингибирует VEGF | очеловеченный | ||
| Противораковые и противовирусные | бавитуксимаб | иммунотерапия , нацелена на фосфатидилсерин | химерный | |
| Другие | паливизумаб | ингибирует слитый белок RSV (F) | очеловеченный | |
| абциксимаб | ингибирует рецептор GpIIb / IIIa на тромбоцитах | химерный |